Chef d'équipe : Thierry Galli
Membre d'équipe : Béatrice Cholley | Lydia Danglot | Paul Heo | Ivan Kortza | Quentin Lemercier | Paul Nazac | Sébastien Nola | Paula Palacios Sanchez | David Tareste | Christian Vannier | Somya Vats | Anais Vlieghe | Shengyan Xu
 |
Notre équipe étudie la dynamique des membranes intracellulaires dans les neurones en développement ou matures, dans un contexte normal ou pathologique. Des anomalies du transport endosomal ou mitochondrial sont liés à une variété de maladies psychiatriques, incluant la dépression et la schizophrénie, mais aussi des maladies neurodégénératives comme Charcot-Marie-Tooth (CMT), Alzheimer, Parkinson et Huntington. Ceci suggère un rôle de la dynamique membranaire dans la formation et le maintien de la morphologie complexe des neurones et de leurs contacts. Les principes moléculaires et cellulaires qui gouvernent l’établissement et le maintien de la morphologie neuronale et des contacts synaptiques restent encore à ce jour mal connus. Le but de l’équipe est de comprendre les mécanismes et la régulation du trafic membranaire dans le contexte du cerveau en développement, les tumeurs cérébrales, les maladies psychiatriques et dégénératives (Parkinson, Alzheimer). Pour cela, nous utilisons des techniques de biologie cellulaire et moléculaire et plus particulièrement des approches microscopiques, protéomiques, ainsi que biophysiques afin d’étudier la dynamique, membranaire in vitro et in vivo. |

Le principe fondamental de la fusion médiée par les SNARE
Adrien V, Bosc N, Fumat H, Tessier C, Ferreri F, Mouchabac S, Tareste D, Nuss P. Higher stress response and altered quality of life in schizophrenia patients with low membrane levels of docosahexaenoic acid. Front Psychiatry. 2023 Feb 3;14:1089724. PMID: 36816405. DOI: 10.3389/fpsyt.2023.1089724
Filippini F, Nola S, Zahraoui A, Roger K, Esmaili M, Sun J, Wojnacki J, Vlieghe A, Bun P, Blanchon S, Rain JC, Taymans JM, Chartier-Harlin MC, Guerrera C, Galli T. Secretion of VGF relies on the interplay between LRRK2 and post-Golgi v-SNAREs. Cell Rep. 2023 Mar 28;42(3):112221. PMID: 36905628. DOI: 10.1016/j.celrep.2023.112221. Download from HAL UPC
Heo P, Culver JA, Miao J, Pincet F, Mariappan M. The Get1/2 insertase forms a channel to mediate the insertion of tail-anchored proteins into the ER. Cell Rep. 2023 Jan 31;42(1):111921. PMID: 36640319. DOI: 10.1016/j.celrep.2022.111921. Download from HAL-INSERM
Niort K, Dancourt J, Boedec E, Al Amir Dache Z, Lavieu G, Tareste D. Cholesterol and Ceramide Facilitate Membrane Fusion Mediated by the Fusion Peptide of the SARS-CoV-2 Spike Protein. ACS Omega. 2023 Sep 12;8(36):32729–32739. PMID: 37720777. DOI: 10.1021/acsomega.3c03610
Vlieghe A, Niort K, Fumat H, Guigner J-M, Cohen MM, Tareste D. Role of lipids and divalent cations in membrane fusion mediated by the heptad repeat domain 1 of mitofusin. Biomolecules. 2023 Sep 2;13(9). PMID: 37759741. DOI: 10.3390/biom13091341
Hewlett B, Pratap Singh N, Vannier C, Galli T. ER-PM Contact Sites – SNARING Actors in Emerging Functions. Front. Cell Dev. Biol. 2021. Feb 11;9:635518. doi: 10.3389/fcell.2021.635518. eCollection 2021. Download from HAL-INSERM Review Article
Vats S, Galli T. Introducing secretory reticulophagy/ER-phagy (SERP), a VAMP7-dependent pathway involved in neurite growth. Autophagy. 2021 Feb 8;:1-3. doi: 10.1080/15548627.2021.1883886. [Epub ahead of print] PubMed PMID: 33554711. Download from HAL-INSERM
Gallo A, Danglot L, Giordano F, Hewlett B, Binz T, Vannier C, Galli T. Role of the Sec22b-E-Syt complex in neurite growth and ramification. J Cell Sci. 2020 Sep 15;133(18):jcs247148. doi: 10.1242/jcs.247148. PMID: 32843578. Download from HAL-INSERM
Wojnacki J, Nola S, Bun P, Cholley B, Filippini F, Pressé MT, Lipecka J, Man Lam S, N'guyen J, Simon A, Ouslimani A, Shui G, Fader CM, Colombo MI, Guerrera IC, Galli T. Role of VAMP7-Dependent Secretion of Reticulon 3 in Neurite Growth. Cell Rep. 2020 Dec 22;33(12):108536. doi: 10.1016/j.celrep.2020.108536. PubMed PMID: 33357422. Download from HAL-INSERM
Collot M, Ashokkumar P, Anton H, Boutant E, Faklaris O, Galli T, Mély Y, Danglot L, Klymchenko AS. MemBright: A Family of Fluorescent Membrane Probes for Advanced Cellular Imaging and Neuroscience. Cell Chem Biol. 2019 Apr 18;26(4):600-614.e7. doi: 10.1016/j.chembiol.2019.01.009. Epub 2019 Feb 7. PubMed PMID: 30745238
Thème général
Thème 1: Rôle des voies de sécrétion dans le développement neuronal et la plasticité
Thème 2: Rôle des contacts membranaires dans le développement neuronal
Bibliographie
Anciens membres
Notre équipe étudie la dynamique des membranes intracellulaires dans les neurones en développement ou matures, dans un contexte normal ou pathologique. Il est particulièrement intrigant que la paraplégie spastique héréditaire, une famille de maladies de dégénérescence axonale, soit déterminée par des mutations dans les gènes impliqués principalement dans la dynamique des organelles, en particulier les mitochondries, le réticulum endoplasmique (RE), les endosomes et les autophagosomes. La perturbation de la dynamique mitochondriale a également été liée à une variété de troubles neurodégénératifs, y compris les maladies de Charcot-Marie-Tooth (CMT), Alzheimer, Parkinson et Huntington. Cela suggère certainement un rôle crucial de la dynamique membranaire dans la formation et le maintien de la morphologie complexe des neurones.
Malgré le grand nombre de publications à ce sujet, les principes moléculaires et cellulaires qui régissent l'établissement de la morphologie neuronale restent à élucider. Comme l'a formulé Karl Pfenninger, l'expansion de la membrane plasmatique (MP) est la tâche herculéenne du neurone (1). L'expansion massive de membrane pendant le développement et le maintien de la grande surface de la cellule durant la vie nécessite l'ajout continu de nouvelles membranes. On pense que cela se produit par la fusion des vésicules de sécrétion avec la MP et que plusieurs voies sont impliquées, transportant différents composants, en fonction du contexte de signalisation (2,3). En outre, nos travaux récents ont montré que des contacts étroits entre le RE, où la plupart des lipides sont synthétisés, et la MP jouent également un rôle dans la croissance des neurites par transfert de lipides non-vésiculaire (4). Ainsi, le type de vésicules sécrétoires impliquées et les mécanismes non-vésiculaires participant à l'expansion de la membrane ne sont toujours pas entièrement connus. Comment les membranes neuronales sont maintenues au cours de la vie et le vieillissement, et la façon dont les mécanismes sous-jacents peuvent être altérés dans la neurodégénérescence restent encore à ce jour des questions ouvertes.
Photo de groupe de l'équipe
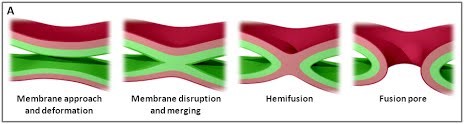
Nous utilisons une approche multidisciplinaire et multi-échelle allant des molécules aux cellules et aux animaux, en mettant l'accent sur les protéines qui sont au cœur des événements de fusion membranaire intracellulaire. Les protéines SNARE constituent la principale machinerie moléculaire pour l'ancrage et la fusion des membranes intracellulaires. Les SNARE sont des protéines transmembranaires qui sont classées dans les R-SNARE, correspondant principalement aux (v)-SNARE vésiculaires, et aux Q-SNARE, principalement (t)-SNARE cibles. Un complexe SNARE fusogénique fonctionnel est composé de trois Q-SNARE (généralement sur le compartiment accepteur) et d'un R-SNARE (sur la membrane opposée, souvent une vésicule). L'assemblage de R / Q-SNARE entre deux membranes sous la forme d'une bobine enroulée parallèle de quatre domaines d’heptad répétés (HR) génère un complexe trans-SNARE qui arrime les bicouches lipidiques et les rapproche pour favoriser la fusion. Ce processus passe souvent par un état intermédiaire d'hémi-fusion, où les monocouches extérieures ont fusionné pendant que les monocouches internes restent séparées. L'ancrage membranaire impliquant les SNARE, en raccourcissant la distance entre les bi-couches, favorise également le transfert de lipides avant ou indépendamment de la fusion.
 |
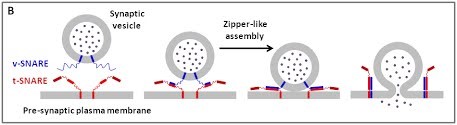 |
Figure 1. (A) Les différentes étapes de la fusion membranaire ; adapté de (Jahn et al., Curr Opin Cell Biol 2002).
(B) La fusion membranaire dépendant des protéines SNARE
Il est généralement convenu que la croissance neuritique au cours du développement neuronal est médiée par une fusion de vésicules dépendant des SNARE avec la MP. Chez les mammifères, les « brevin » v-SNARE VAMP2, VAMP4 et la « Longin » v-SNARE VAMP7 ont été impliquées dans la croissance neuronale et leur participation semble dépendre de voies de signalisation impliquant les intégrines, Netrin ou NGF [revue dans (2,3 )]. Notre équipe se concentre particulièrement sur le rôle des brevins VAMP2 et VAMP3 et les Longins v-SNAREs VAMP7 et Sec22b.
Figure 2. Représentation schématique de la formation de synapses durant la neuritogenèse
Les mitochondries forment un réseau très dynamique d'organites qui se déplacent, fusionnent et se divisent constamment dans les cellules. Cette nature dynamique des mitochondries est essentielle à la fonction cellulaire, et les mutations des protéines de la fusion et de fission mitochondriales conduisent à des maladies humaines importantes. Mitofusins, Mfn1 et Mfn2, sont de grandes protéines transmembranaires à activité GTPasique de la membrane mitochondriale externe qui sont cruciales pour la fusion mitochondriale. Les Mitofusines possèdent, en plus de leurs domaines GTPase et transmembranaire, deux domaines répétitifs Heptad, HR1 et HR2. Des mutations dans l'un de ces domaines fonctionnels nuisent à la fonction de Mitofusin et peuvent conduire à la maladie CMT2A dans le cas de mutations dans Mfn2, mais leur rôle exact dans la fusion mitochondriale reste inconnu (pour plus de détails: https://sites.google.com/site / Insertmu950 / Biophysique-de-membrane-fusion). La structure cristalline aux rayons X du domaine HR2 de Mfn1 a révélé un dimère de domaines coiled-coil anti-parallèle suggérant un rôle pour HR2 dans l'ancrage mitochondrial. La fusion mitochondriale est également régulée par des lipides spécifiques tels que la cardiolipine (CL), la phosphatidyléthanolamine (PE) et l'acide phosphatidique (PA). On pense que ces lipides sont échangés entre le RE et les mitochondries via des sites de contact membranaire (MCS). Fait intéressant, le RE et les mitochondries se sont révélés être physiquement liés par des complexes homotypiques et hétérotypiques impliquant Mfn2 sur le RE et Mfn1 ou Mfn2 sur la membrane mitochondriale externe. Notre principal objectif est donc de préciser les mécanismes moléculaires par lesquels les Mitofusines participent à la fusion mitochondriale et la façon dont ce processus est régulé par les lipides et couplé fonctionnellement à la machinerie de transfert lipidique au niveau des MCS RE-mitochondries.
Figure 3. Images de fusion et fission de mitochondries
|
|
Articles principaux : Zylbersztejn et al. J Cell Biol 2012; Danglot, Freret et al, J Neurosci, 2012 ; Danglot, Zylbersztejn et al, J Neurosci, 2012 ; Burgo et al, Dev Cell, 2012, Burgo et al., J Biol Chem 2013 ; Molino et al., Cell Logist 2015; Kuster et al, J Biol Chem 2015
|
Nous avons également constaté que VAMP7 était impliqué dans l'exocytose des vésicules dérivées de Golgi (10) et que sa délétion modifie l'exocytose et la composition membranaires en sphingolipides (11). L'exocytose de VAMP7 est régulée par l'IGF-1 et la phosphorylation d'une tyrosine dans le domaine Longin amino-terminal (12).
De plus, dans la continuité d’études antérieures, nous avons complété la carte d'interaction de VAMP7 et caractérisé la fonction de ses partenaires: Varp, GolginA4, Rab21, MACF-1, Kif5a (10), SNAP-47 et SNAP-29 (13) dans l'exocytose et la croissance neuritique.
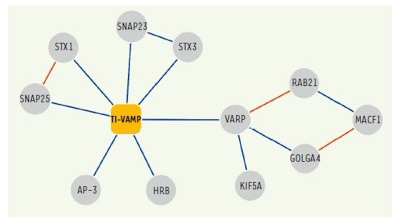
Figure 4. Réseau d'interactions moléculaires de TI-VAMP / VAMP-7.
Les interactions identifiées dans nos cribles double-hybride et / ou les approches biochimiques sont présentées en bleu.
(Burgo et al., 2012a)
Le rôle du VAMP7 dans les mécanismes de sécrétion dans les cellules immunitaires (lymphocytes B et T et cellules dendritiques) et les cellules sanguines a été le sujet de plusieurs collaborations (14-17). La souris VAMP7 KO a contribué à démontrer l'importance des mécanismes de sécrétion médiés par VAMP7 dans le système immunitaire.
Nous avons réussi à caractériser le réseau moléculaire de VAMP7 et à déchiffrer davantage ses fonctions dans la sécrétion, la croissance des neurites et la signalisation cérébrale. De futures études sont nécessaires pour comprendre plus précisément la contribution de chaque mécanisme de sécrétion in vivo.
 |
Articles principaux : Petkovic et al, Nature Cell Biol, 2014, Gallo et al, Annu. Rev. Cell Dev. Biol, 2016
|
1. Pfenninger KH. Plasma membrane expansion: a neuron’s Herculean task. Nat Rev Neurosci. 2009 Apr;10(4):251–261.
2. Wojnacki J, Galli T. Membrane traffic during axon development. Dev Neurobiol. 2016 Nov;76(11):1185–1200.
3. Daste F, Galli T, Tareste D. Structure and function of longin SNAREs. J Cell Sci. 2015 Dec 1;128(23):4263–4272.
4. Petkovic M, Jemaiel A, Daste F, Specht CG, Izeddin I, Vorkel D, et al. The SNARE Sec22b has a non-fusogenic function in plasma membrane expansion. Nat Cell Biol. 2014 May;16(5):434–444.
5. Zylbersztejn K, Petkovic M, Burgo A, Deck M, Garel S, Marcos S, et al. The vesicular SNARE Synaptobrevin is required for Semaphorin 3A axonal repulsion. J Cell Biol. 2012 Jan 9;196(1):37–46.
6. Danglot L, Freret T, Le Roux N, Narboux Nême N, Burgo A, Hyenne V, et al. Vezatin is essential for dendritic spine morphogenesis and functional synaptic maturation. J Neurosci. 2012 Jun 27;32(26):9007–9022.
7. Danglot L, Zylbersztejn K, Petkovic M, Gauberti M, Meziane H, Combe R, et al. Absence of TI-VAMP/Vamp7 leads to increased anxiety in mice. J Neurosci. 2012 Feb 8;32(6):1962–1968.
8. Sato M, Yoshimura S, Hirai R, Goto A, Kunii M, Atik N, et al. The role of VAMP7/TI-VAMP in cell polarity and lysosomal exocytosis in vivo. Traffic. 2011 Oct;12(10):1383–1393.
9. Ghosh D, Pinto S, Danglot L, Vandewauw I, Segal A, Van Ranst N, et al. VAMP7 regulates constitutive membrane incorporation of the cold-activated channel TRPM8. Nat Commun. 2016 Feb 4;7:10489.
10. Burgo A, Proux-Gillardeaux V, Sotirakis E, Bun P, Casano A, Verraes A, et al. A molecular network for the transport of the TI-VAMP/VAMP7 vesicles from cell center to periphery. Dev Cell. 2012 Jul 17;23(1):166–180.
11. Molino D, Nola S, Lam SM, Verraes A, Proux-Gillardeaux V, Boncompain G, et al. Role of tetanus neurotoxin insensitive vesicle-associated membrane protein in membrane domains transport and homeostasis. Cell Logist. 2015 Mar;5(1):e1025182.
12. Burgo A, Casano AM, Kuster A, Arold ST, Wang G, Nola S, et al. Increased activity of the vesicular soluble N-ethylmaleimide-sensitive factor attachment protein receptor TI-VAMP/VAMP7 by tyrosine phosphorylation in the Longin domain. J Biol Chem. 2013 Apr 26;288(17):11960–11972.
13. Kuster A, Nola S, Dingli F, Vacca B, Gauchy C, Beaujouan J-C, et al. The Q-soluble N-Ethylmaleimide-sensitive Factor Attachment Protein Receptor (Q-SNARE) SNAP-47 Regulates Trafficking of Selected Vesicle-associated Membrane Proteins (VAMPs). J Biol Chem. 2015 Nov 20;290(47):28056–28069.
14. Chiaruttini G, Piperno GM, Jouve M, De Nardi F, Larghi P, Peden AA, et al. The SNARE VAMP7 Regulates Exocytic Trafficking of Interleukin-12 in Dendritic Cells. Cell Rep. 2016 Mar 22;14(11):2624–2636.
15. Larghi P, Williamson DJ, Carpier J-M, Dogniaux S, Chemin K, Bohineust A, et al. VAMP7 controls T cell activation by regulating the recruitment and phosphorylation of vesicular Lat at TCR-activation sites. Nat Immunol. 2013 Jul;14(7):723–731.
16. Schena F, Volpi S, Faliti CE, Penco F, Santi S, Proietti M, et al. Dependence of immunoglobulin class switch recombination in B cells on vesicular release of ATP and CD73 ectonucleotidase activity. Cell Rep. 2013 Jun 27;3(6):1824–1831.
17. Koseoglu S, Peters CG, Fitch-Tewfik JL, Aisiku O, Danglot L, Galli T, et al. VAMP-7 links granule exocytosis to actin reorganization during platelet activation. Blood. 2015 Jul 30;126(5):651–660.